一、强、弱电解质的相关判断
1.看法和种类
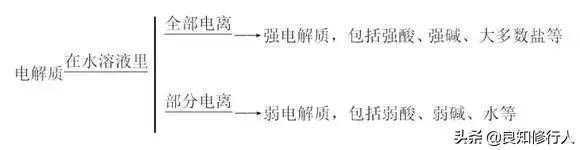

2.电离、电解质、非电解质、强电解质和弱电解质的相互关系
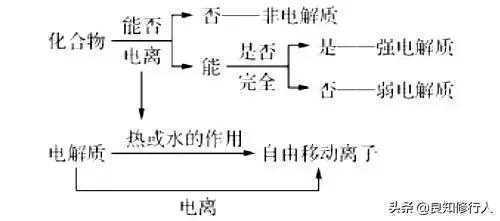



3.强、弱电解质与化合物类型的关系
强电解质主要是大部门的离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
分类
举例
强电解质
①强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等
②强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2等
③大多数盐:钠盐、钾盐、硝酸盐等
弱电解质
①弱酸:CH3COOH、H2CO3、HF、HCN、HClO、H2S等;H3PO4、H2SO3是中强酸,也属于弱电解质
②弱碱:NH3·H2O,多数不溶性的碱[如Fe(OH)3、Cu(OH)2等]、两性氢氧化物[如Al(OH)3等]
③水:是极弱的电解质
4.电离方程式的誊写
①弱电解质
a.多元弱酸分步电离,且第一步电离水平远远大于第二步,如H2CO3电离方程式:
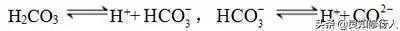

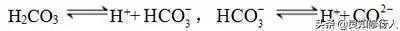

b.多元弱碱电离方程式一步写成,如Fe(OH)3电离方程式:




②酸式盐
a.强酸的酸式盐完全电离,如NaHSO4电离方程式:NaHSO4===Na++H++SO42-
b.弱酸的酸式盐中酸式酸根不能完全电离,如NaHCO3电离方程式:NaHCO3===Na++HCO3–,HCO3–===H++CO32-。
二、弱电解质的电离特点与影响因素
1.电离平衡




(1)最先时,v电离最大,而v连系即是0。
(2)平衡确立过程中,v电离逐渐减小,v连系逐渐增大,但v电离>v连系。
(3)当v电离=v连系时,到达电离平衡状态。
2.电离平衡的特征




3.影响电离平衡的因素
(1)内因——弱电解质自己的性子。
(2)外因——外界条件
①温度:温度升高,电离平衡向右移动,电离水平增大。
②浓度:稀释溶液,电离平衡向右移动,电离水平增大。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡向左移动,电离水平减小。
④加入能反映的物质:电离平衡向右移动,电离水平增大。
三、一元强酸(碱)与一元弱酸(碱)的对照
1.等物质的量浓度、相同体积的一元强酸与一元弱酸的对照
对照项目酸
c(H+)
pH
中和碱
的能力
与足量Zn
反映发生H2的量
最先与金
属反映的速率
一元强酸
cps和cpa区别,盘点这两者之间的三个异同点
大
小
相同
相同
大
一元弱酸
小
大
小
2.相同pH、相同体积的一元强酸与一元弱酸的对照
对照项目酸
c(H+)
c(酸)
中和碱的能力
与足量Zn
反映发生H2的量
最先与金
属反映的速率
一元强酸
相同
小
小
少
相同
一元弱酸
大
大
多
说明:一元强碱与一元弱碱的对照纪律与以上类似。
四、弱电解质漫衍系数的图像剖析
漫衍系数是指弱电解质溶液中,某一组分的平衡浓度占总浓度的分数,常用δ示意。漫衍曲线是以pH为横坐标,漫衍系数为纵坐标,漫衍系数与溶液pH之间的关系曲线。
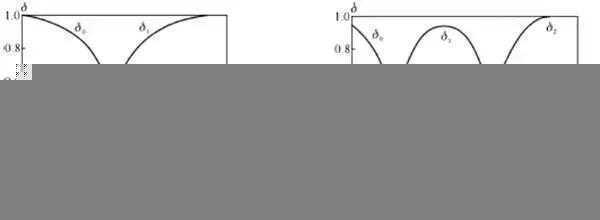



1.一元弱酸:以醋酸为例,对于总浓度为c的CH3COOH溶液,溶液中与CH3COOH相关的只有c(CH3COOH)和c(CH3COO-)两种,则c=c(CH3COOH)+c(CH3COO-),从图1中得出:CH3COOH漫衍系数为δ0,CH3COO-漫衍系数为δ1,δ1随着pH的升高而增大,δ0随着pH的升高而减小。当pH<pKa时,主要形体是CH3COOH;当pH>pKa时,主要形体是CH3COO-。δ0与δ1曲线相交在δ0=δ1=0.5处,此时c(CH3COOH)=c(CH3COO-),即pH=pKa,CH3COOH和CH3COO-各占一半。这一结论可应用于任何一元弱酸(碱)。同时,只要知道某一元弱酸(碱)在一定pH的漫衍系数和酸(碱)的剖析浓度,就很容易盘算它在该pH时的平衡浓度。
2.二元酸:以草酸为例(碳酸与之相似),其δ与pH曲线如图2所示,δ0为H2C2O4、δ1为、δ2为。由图2看出,当溶液的pH=pKa1时δ0=δ1,pH=pKa2时δ1=δ2。当pH<pKa1时,H2C2O4占优势;在pKa1<pH<pKa2区间,H占优势;当pH>pKa2时,为主要存在形体。由盘算可知,在pH=2.75时H占94.2%,而H2C2O4和分别为2.6%和3.2%,说明在H占优势的区域内,三种形体可以同时存在。
判断强、弱电解质的方式
1.电解质是否完全电离
在溶液中强电解质完全电离,弱电解质部门电离。据此可以判断HA是强酸照样弱酸,如:若测得0.1 mol/L的HA溶液的pH=1,则HA为强酸;若pH>1,则HA为弱酸。
2.是否存在电离平衡
强电解质不存在电离平衡,弱电解质存在电离平衡,在一定条件下电离平衡会发生移动。
(1)一定pH的HA溶液稀释前后pH的转变:
将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为强酸,若pH<5,则为弱酸。
(2)升高温度后pH的转变:若升高温度,溶液的pH显著减小,则是弱酸。由于弱酸存在电离平衡,升高温度时,电离水平增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只有水的电离水平增大,pH转变幅度小。
3.酸根离子(或弱碱阳离子)是否能发生水解
强酸根离子不水解,弱酸根离子易发生水解,据此可以判断HA是强酸照样弱酸。可直接测定NaA溶液的pH:若pH=7,则HA是强酸;若pH>7,则HA是弱酸。
外界条件对弱电解质电离的影响




一元强酸(碱)和一元弱酸(碱)稀释时的pH转变图像




客服微信:( 181628402)本文链接: https://www.n5w.com/243805.html


版权声明:本文内容由互联网用户自觉孝敬,该文看法仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不负担相关法律责任。如发现本站有涉嫌剽窃侵权/违法违规的内容, 请发送邮件至 394062665@qq.com 举报,一经查实,本站将马上删除。
本文来源于自互联网,不代表n5网立场,侵删。发布者:虚拟资源中心,转载请注明出处:https://www.n5w.com/260418.html

 微信扫一扫
微信扫一扫